- Department of Psychology, Memorial University of Newfoundland, 232 Elizabeth Ave., St. John’s, Newfoundland A1B 3X9, Canada
 Abstract
Abstract
The
mammalian target of rapamycin (mTOR) kinase is a critical regulator of
mRNA translation and is known to be involved in various long lasting
forms of synaptic and behavioural plasticity.
However, information
concerning the temporal pattern of mTOR activation and susceptibility to
pharmacological intervention during both consolidation and
reconsolidation of long-term memory (LTM) remains scant.
Male
C57BL/6 mice were injected systemically with rapamycin at various time
points following conditioning or retrieval in an auditory fear
conditioning paradigm, and compared to vehicle (and/or anisomycin)
controls for subsequent memory recall.
Systemic
blockade of mTOR with rapamycin immediately or 12 h after training or
reactivation impairs both consolidation and reconsolidation of an
auditory fear memory.
Further behavioural analysis revealed that the
enduring effects of rapamycin on reconsolidation are dependent upon
reactivation of the memory trace.
Rapamycin, however, has no effect on
short-term memory or the ability to retrieve an established fear memory.
Collectively,
our data suggest that biphasic mTOR signalling is essential for both
consolidation and reconsolidation-like activities that contribute to the
formation, re-stabilization, and persistence of long term auditory-fear
memories, while not influencing other aspects of the memory trace.
These findings also provide evidence for a cogent treatment model for
reducing the emotional strength of established, traumatic memories
analogous to those observed in acquired anxiety disorders such as
posttraumatic stress disorder (PTSD) and specific phobias, through
pharmacologic blockade of mTOR using systemic rapamycin following
reactivation.
_______________________________________________________
5 September 2013
___________________________________________________________________________________
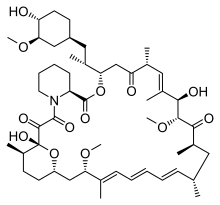
Sirolimus
| Sirolimus | |
|---|---|
 |
|
 |
|
| Nombre (IUPAC) sistemático | |
| (3S,6R,7E,9R,10R,12R,14S,15E,17E,19E,21S,23S, 26R,27R,34aS)-9,10,12,13,14,21,22,23,24,25,26, 27,32,33,34,34a-hexadecahydro-9,27-dihydroxy-3- [(1R)-2-[(1S,3R,4R)-4-hydroxy-3-methoxycyclohexyl]- 1-methylethyl]-10,21-dimethoxy-6,8,12,14,20,26- hexamethyl-23,27-epoxy-3H-pyrido[2,1-c][1,4]- oxaazacyclohentriacontine-1,5,11,28,29 (4H,6H,31H)-pentone |
|
| Identificadores | |
| Número CAS | 53123-88-9 |
| Código ATC | L04AA10 |
| PubChem | 6436030 |
| Datos químicos | |
| Fórmula | C51H79NO13 |
| Peso mol. | 914.172 g/mol |
| Farmacocinética | |
| Biodisponibilidad | 20%, menos después de comidas ricas en grasa |
| Unión proteica | 92% |
| Metabolismo | Hepático |
| Vida media | 57–63 horas |
| Excreción | Principalmente fecal |
| Datos clínicos | |
| Cat. embarazo | C |
| Estado legal | Venta con receta medica. |
| Vías de adm. | Oral |
Tiempo después, el medicamento mostró eficacia para combatir algunos cánceres, al frenar la proliferación celular y el crecimiento de los tumores.
Por esta propiedad igualmente se usa para recubrir stents medicados de uso intracoronario y evitar su reestenosis.5
En julio de 2009, un artículo en la revista Nature demostraba que este medicamento prolongó hasta en un 38% la vida de unos ratones,6 hallazgo que abre expectativas sobre su uso en tratamientos para retrasar el envejecimiento humano.
Se comercializa bajo el nombre comercial de Rapamune por Wyeth.
Mecanismo de acción
A diferencia de su similar, el tacrolimus, el sirolimus no es un inhibidor de calcineurina. Sin embargo, tiene un efecto inmunosupresor similar sobre el sistema inmune. El sirolimus inhibe la respuesta a la interleucina-2 (IL-2) y de esa forma bloquea la activación de los linfocitos T y B. El tacrolimus además inhibe la producción de IL-2.El mecanismo de acción del sirolimus es mediante la unión a las proteínas citosolicas FKBP12 (del inglés FK-binding protein 12) de forma similar al tacrolimus. Sin embargo, a diferencia del complejo tacrolimus/FKBP12 que inhibe la calcineurina (PP2B), el complejo sirolimus/FKBP12 inhibe la vía del mTOR (del inglés mammalian target of rapamycin) por la unión al complejo mTOR (mTORC1). El complejo mTOR es también llamado FRAP (del inglés FKBP-rapamycin associated protein) o RAFT (del inglés rapamycin and FKBP target). La denominación FRAP y RAFT son actualmente más adecuados dado que reflejan el hecho que el sirolimus debe unirse primero al FKBP12 y solo el complejo FKBP12/rapamycin puede unirse al FRAP/RAFT/mTOR.
mTOR es una proteína quinasa serina/treonina que regula el crecimiento, la proliferación, la motilidad y la supervivencia celulares, además de la síntesis de proteínas y la transcripción.7 8
Uso en trasplantes
La principal ventaja que el sirolimus tiene sobre los inhibidores de calcineurina, es la de tener baja toxicidad renal.Los pacientes trasplantados en tratamiento con inhibidores de calcineurina a largo plazo tienden a perder función renal e incluso llegar a la falla renal terminal; esto puede evitarse con el uso del sirolimus.
Es particularmente ventajoso en pacientes trasplantados a causa del Síndrome urémico hemolítico, ya que esta enfermedad es probable que recurra en el riñón trasplantado si es usado un inhibidor de calcineurina. Sin embargo, en octubre 7 de 2008, la FDA aprobo un marca de revisión de la seguridad del sirolimus para advertir del riesgo de disminución de la función renal con su uso.
El sirolimus puede ser usado solo o en combinación con inhibidores de la calcineurina y/o micofenolato, proveyendo así regímenes de inmunosupresión libres de esteroides. Sin embargo disminución en la curación de heridas y trombocitopenia es un posible efecto colateral del sirolimus, por ello muchos centros de trasplante prefieren no usarlo inmediatamente después de la operación de trasplante, en lugar de ello es administrado solo después de un periodo de semanas o meses. Su desempeño óptimo como inmunosupresor todavía no ha sido determinado, y es sujeto de una cantidad de ensayos clínicos en desarrollo.
Incremento de la esperanza de vida en ratones
En un estudio de 2009, la esperanza de vida de ratones recibiendo se incrementó entre 28-38% desde el inicio del tratamiento, o 9-14% en total de incremento en la esperanza de vida máxima. Es de notar que el tratamiento se inició en ratones de 20 meses, el equivalente a 60 años humanos. Esto sugiere la posibilidad de un tratamiento anti envejecimiento efectivo para humanos en edad ya avanzada, sin requerir un tratamiento a largo plazo desde la juventud.9 Sin embargo, debido a la fuerte supresión del sistema inmune, el medicamento no puede ser fácilmente usado en humanos. Mientras que los ratones estaban confinados en un medio libre de patógenos, los humanos tomando sirolimus son muy susceptibles a las infecciones en forma permanente, requiriendo supervisión médica permanente.10Efectos anti proliferativos
Los efectos antiproliferativos del sirolimus han sido usados en el contexto de los stents coronarios para prevenir la estenosis de las arterias coronarias posterior a la angioplastia con balón.El sirolimus es prescrito en una capa polimérica que permite la liberación prolongada durante el periodo de cicatrización posterior a la intervención coronaria.
Algunos estudios clínicos extensos han demostrado tasas bajas de reestenosis en pacientes tratados con stens liberadores de sirolimus, comparado con aquellos de metal desnudo, resultando en menos reintervenciones. Un sten coronario liberador de sirolimus es comercializado por Cordis, una división de Johnson & Johnson, bajo el nombre comercial de 'Cypher'.11 Ha sido propuesto sin embargo que tales stens pueden incrementar el riesgo de trombosis vascular.12
En forma adicional el sirolimus actualmente está siendo sugerido como una opción terapéutica para la Enfermedad poliquística renal autosómica dominante. Casos reportados indican que el sirolimus puede reducir el volumen renal y demorar la pérdida de función renal en pacientes con esta patología,13 de igual forma algunos estudios están evaluando su eficacia como opción en el tratamiento de la fibrosis pulmonar.14
Esclerosis tuberosa
El Sirolimus también es promisorio en el tratamiento de la esclerosis tuberosa, un desorden congénito en el cual existe una propensión al crecimiento de tumores benignos en el cerebro, corazón, riñones, piel y otros órganos. Después de algunos estudios se relacionó en forma conclusiva los inhibidores de mTOR a la remisión de tumores en la esclerosis tuberosa, específicamente astrocitomas subependimarios de células gigantes en niños y angiolipomas en adultos, muchos médicos en los EE.UU empezaron a prescribir el sirolimus a pacientes con esclerosis tuberosa sin estar aprobado por la FDA. Numerosos estudios clínicos utilizando sirolimus y análogos, involucrando adultos y niños con esclerosis tuberosa, se encuentran en curso en los Estados Unidos.15La mayoría de estudios han mostrado claramente que los tumores a menudo recidivan cuando el tratamiento es suspendido. Se teoriza que el medicamento aminoras los síntomas de la esclerosis tuberosa como los angiofibromas faciales TDAH, y autismo son un tema de investigación actual en modelos animales.
Cáncer
Los efectos antiproliferativos del sirolimus pueden tener un role en el tratamiento del cáncer. Recientemente se demostró que el sirolimus inhibía la progresión del Sarcoma de Kaposi en pacientes con trasplante renal. Otros inhibidores de la mTOR tales como el temsirolimus (CCI-779) o everolimus (RAD001) están siendo probados para su uso en canceres como el glioblastoma multiforme y Linfoma de células de manto.La combinación de doxorrubicina y sirolimus ha demostrado llevar los linfomas AKT positivos a la remisión en ratones. Las señales mediadas por las Akt promueven la supervivencia celular en linfomas Akt positivos y actúa previniendo los efectos citotoxicos de los fármacos quimioterapeuticos como la doxorrubicina o ciclofosfamida. El Sirolimus bloquea las deñales de las Akt y las células pierden la resistencia a la quimioterapia. Bcl-2-positive lymphomas were completely resistant to the therapy; nor are eIF4E expressing lymphomas sensitive to sirolimus.16 17 18 19
El panobinostat ha demostrado actuar sinergicamente con el sirolimus para matar células pancreáticas en el laboratorio, en un estudio de la clínica Mayo. En el mencionado estudio, los investigadores encontraron que esta combinación destruía hasta el 65% de las células pancreáticas tumorales cultivadas. El hallazgo es significativo porque las tres líneas celulares estudiadas eran todas resistentes a los efectos de la quimioterapia, como la mayoría de los tumores pancreáticos.20
Como con todos los medicamentos inmunosupresores, el sirolimus disminuye la actividad anti oncogénica del organismo y permite la proliferación de algunos canceres los cuales serían normalmente destruidos. Los pacientes inmunosuprimidos, tiene un riesgo de cáncer de 10 a 100 veces más alto que la población general. Además, los pacientes quienes actualmente tienen o han sido tratados para el cáncer, tienen una alta tasa más alta de probabilidad de progresión del tumor y recurrencia que los pacientes con un sistema inmune intacto.
_______________________________________________________________________________
fuente: Wikipedia.


No hay comentarios:
Publicar un comentario